Промислова екологія - Апостолюк C. O. - 5.5. Хімічне очищення стічних вод
Хімічне очищення стічних вод здійснюють переважно трьома способами: нейтралізацією, окисленням і відновленням.
Нейтралізацію проводять для доведення рН січних вод до 6,5-8,5, тобто близького до нейтрального. Отже, нейтралізувати потрібно стічні води з рН < 6,5 (з кислою реакцією середовища) і з рН > 8,5 (з лужною реакцією середовища). Нейтралізацію здійснюють змішуванням кислот стічних вод з лугами додаванням реагентів або фільтруванням через нейтралізуючі матеріали.
Кількість реагенту для нейтралізації стічних вод визначається за формулою
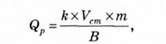
Де /г - коефіцієнт запасу реагенту; В - вміст активної речовини у стічній воді; V - об'єм стічних вод, м3; т - витрата реагенту для нейтралізації активних речовин, кг/м3.
Практика свідчить, що найбільшу небезпеку для навколишнього середовища створюють кислі стоки.
При хімічному очищенні застосовують такі способи нейтралізації:
- взаємну нейтралізацію кислих і лужних стічних вод змішуванням;
- нейтралізацію стічних вод реагентами (розчинами кислот, негашеним вапном СаО, гашеним вапном Са(ОН)2, кальцинованою содою N8003, каустичною содою КаОН, розчином аміаку
№ЕЇ4ОН);
- фільтруванням стічних вод через нейтралізуючі матеріали (вапно, вапняк СаС08, доломіт СаС03 - MgC08, магнезит MgCOз, крейда СаС03).
Вибір способу нейтралізації стічних вод залежить від багатьох факторів: виду та концентрації кислот у стічних водах; витрат і режиму подачі відпрацьованих вод на нейтралізацію; наявності реагентів і місцевих умов та ін.
Нейтралізацію розчином вапна й вапняку рекомендують проводити тільки при рівномірній подачі стічних вод, що містять сильні кислоти. Фільтрування через шари вапняку, доломіту й крейди рекомендують для стічних вод, що містять соляну, азотну, сірчану кислоти при рівномірній подачі стічних вод.
В останні роки запропонований спосіб нейтралізації лужних стічних вод димовими газами, які містять С02, 802, N0" та ін. Це дозволяє одночасно очищати й гази, які відходять.
На рис. 5.12, а наведена схема доломітового фільтра-нейтралізатора. У ньому проводиться нейтралізація кислих стічних вод, забруднених соляною, сірчаною або азотною кислотами фільтруванням через шар доломіту. При цьому протікає така хімічна реакція:
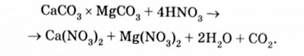
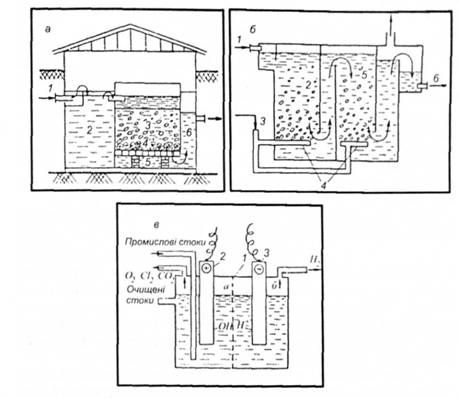
Рис. 5.12. Основні види обладнання для хімічного очищення стічних вод: а - вертикальний доломітовий фільтр-нейтралізатор: 1 - подавання кислих стічних вод; 2 - приймальна камера; З-доломітовий фільтр; 4 - гравій; 5 - дренаж; 6 - випуск нейтралізованих стічних вод; б - контактна камера озонування стічних вод: І - подавання стічних вод; 2,6 - камера озонування; 3 - введення озону; 4 - металокерамічні розпилювальні труби; 6 - вивід стічних вод; в - камера електролітичного знешкодження (анодного окислення): 1 - напівпроникна перегородка; 2 - анод; 3 - катод
Після відпрацювання доломіт вивантажують з фільтра і заміняють свіжим.
Процес нейтралізації постійно контролюється - систематично реєструється стан рН на виході із нейтралізатора. Стабільність і безперебійність роботи фільтра забезпечується надійною автоматикою.
Окислення застосовують для знешкодження виробничих стічних вод, в складі яких є токсичні домішки або сполуки, що недоцільно вилучати. На практиці часто застосовують окислювачі: хлор, хлорне вапно, діоксид хлору, озон, технічний кисень, гіпохлорид кальцію і натрію, кисень та ін.
Залежно від агрегатного стану хлору або хлоровмісних реагентів, що вводять у воду, визначають технологію оброблення стічних вод. Якщо цю воду обробляють газоподібним хлором або озоном, то процес окислення здійснюють в окислювальних колонках або контактних камерах (рис. 5.12, б). Якщо окислювач знаходиться в розчині, то його спочатку подають у змішувач, а потім у контактний резервуар.
При окисленні розчинені отруйні речовини перетворюють у нетоксичні сполуки або в осад відстоюванням або фільтруванням стічних вод.
Хлор, що вводиться у стічну воду, гідролізується з утворенням хлорнуватистої та соляної кислот [1]:
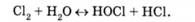
Сильнішим окислювачем, ніж хлор, є озон. Він володіє здатністю руйнувати при нормальній температурі у стічних водах значну кількість органічних сполук і домішок. Озон добувають безпосередньо на очисних спорудах в озонаторах. Він утворюється при електричному розряді в кисневому середовищі між двома електродами, до яких підводиться напруга 5-25 кВ.
У процесі оброблення стічних вод озон, що подаєтеся в контактну камеру (див. рис. 5.12, б) у вигляді суміші, вступає в хімічні реакції з речовинами, що забруднюють воду.
Наведемо приклад характеру реакції окислення сірководню [1]:
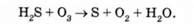
При надлишку озону переважає реакція, в результаті якої утворюється сірчана кислота:

Після цього протікає реакція гідролізу до утворення мало-шкідливих продуктів. Цей спосіб окислення озоном у практиці називають озонуванням.
Озонування дає можливість одночасно знебарвлювати воду, усуває її присмаки, неприємні запахи тощо. Озонуванням можна очищати стічні води від фенолів, нафтопродуктів, поверхнево-активних речовин (ПАР), барвників у ароматичних вуглеводнів, пестицидів на промислових підприємствах.
Озон як окислювач має унікальні властивості. У водному розчині він дисоціює швидше, ніж у повітрі; дуже швидко дисоціює в слабколужних розчинах. У кислотних розчинах озон виявляє високу стійкість. У чистому сухому повітрі озон розкладається дуже повільно. При обробленні води озоном відбуваються розкладання органічних речовин і знешкодження води; бактерії гинуть у декілька тисяч разів швидше, ніж при обробленні хлором, розчинність озону у воді залежить від рН і вмісту у воді розчинених речовин. Невеликий вміст кислот і нейтральних солей збільшує розчинність озону.
Дія озону в процесах окислення може відбуватися трьома способами: безпосереднє окислення за участі одного атома кисню; приєднання цілої молекули озону до речовини, що окислюється з утворенням озонідів; окислювальна дія кисню за допомогою каталізатора - озону.
Озон подають у стічну воду у вигляді озоно-кисневої суміші. Концентрація озону в суміші - близько 3 %. Для підсилення процесу окислення суміш диспергують у стічній воді на дрібненькі бульбашки газу (див. рис. 5.12, б). Озонування - це процес абсорбції, який супроводжується хімічною реакцією в рідкій фазі. Витрата озону, необхідного для окислення забруднень, може визначатись за рівнянням масообміну:
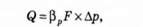
Де ф - витрата озону, що переходить із газової фази в рідку, кг/с; Рр - коефіцієнт масовіддачі в рідкій фазі при протіканні в ній хімічної реакції, м/с; .Р - поверхня контакту фаз, м2; Ар - рушійна сила процесу, кг/м8.
Озон отримують із кисню повітря під дією електричного розряду в генераторах.
Метод відновлення застосовують для очищення стічних вод у випадках наявності легковідновлюваних речовин (ртуть, миш'як, хром). На промислових підприємствах цей метод застосовують рідко.
Разом з озонуванням і хлоруванням виробничих стічних вод застосовують електрохімічне окислення, що грунтується на електролізі виробничих стічних вод (див. рис. 5.12, в). Основу електролізу виробничих стічних вод становлять два процеси: анодне окислення і катодне відновлення.
На аноді, виготовленому з платини або графіту, виділяються кисень і галогени, а також окисляються деякі органічні сполуки, наявні у стічних водах. На катоді виділяється водень і відновлюються деякі органічні сполуки. Внаслідок високої вартості електрохімічне окислення для очищення стічних вод має обмежене застосування.
Схожі статті
-
Промислова екологія - Апостолюк C. O. - 5.2. Механічне очищення стічних вод
5.1. Основні способи очищення стічних вод Попередження забруднення виробничих стічних вод на промислових підприємствах може бути забезпечене...
-
Промислова екологія - Апостолюк C. O. - 5.1. Основні способи очищення стічних вод
5.1. Основні способи очищення стічних вод Попередження забруднення виробничих стічних вод на промислових підприємствах може бути забезпечене...
-
Промислова екологія - Апостолюк C. O. - 5.3. Фізичне очищення стічних вод
До фізичних способів очищення стічних вод належать насамперед випарювання, виморожування та ін. При цьому вирішальним фактором є температура. Тому такі...
-
5.1. Основні способи очищення стічних вод Попередження забруднення виробничих стічних вод на промислових підприємствах може бути забезпечене...
-
Каталітичне очищення грунтується на процесі знешкодження шкідливих домішок, зокрема метену, етилену, пропілену, пропану, ацетону, етилацетату, бензолу,...
-
Промислова екологія - Апостолюк C. O. - 5.4. Фізико-механічне очищення стічних вод
Фізико-механічні способи очищення стічних вод базуються на флотації, мембранних технологіях очищення та азотропному відгоні. Флотація - найбільш...
-
Очищення атмосферного повітря від токсичних парів формальдегіду, що виділяється при варінні сечовино-формальдегідних смол і приготуванні клеїв,...
-
Очищення атмосферного повітря від токсичних парів формальдегіду, що виділяється при варінні сечовино-формальдегідних смол і приготуванні клеїв,...
-
Промислова екологія - Апостолюк C. O. - 2.2.1. Формування стічних вод
2.2.1. Формування стічних вод На території промислових підприємств утворюються стічні води трьох видів: побутові, поверхневі (зливні) та виробничі....
-
4.1. Основні методи очищення атмосферного повітря від шкідливих парів і газів Очищення та знешкодження технологічних і вентиляційних викидів промислових...
-
Промислова екологія - Апостолюк C. O. - Металургійні та ливарні цехи
2.2.1. Формування стічних вод На території промислових підприємств утворюються стічні води трьох видів: побутові, поверхневі (зливні) та виробничі....
-
2.2.1. Формування стічних вод На території промислових підприємств утворюються стічні води трьох видів: побутові, поверхневі (зливні) та виробничі....
-
4.1. Основні методи очищення атмосферного повітря від шкідливих парів і газів Очищення та знешкодження технологічних і вентиляційних викидів промислових...
-
2.2.1. Формування стічних вод На території промислових підприємств утворюються стічні води трьох видів: побутові, поверхневі (зливні) та виробничі....
-
Промислова екологія - Апостолюк C. O. - Розділ 2. НАВКОЛИШНЄ СЕРЕДОВИЩЕ НА ПРОМИСЛОВИХ ПІДПРИЄМСТВАХ
2.1. Основні джерела забруднення атмосферного повітря на промислових підприємствах 2.1.1. Концепція "джерела забруднення" атмосфери "Джерело забруднення"...
-
2.1. Основні джерела забруднення атмосферного повітря на промислових підприємствах 2.1.1. Концепція "джерела забруднення" атмосфери "Джерело забруднення"...
-
Промислова екологія - Апостолюк C. O. - 2.1.1. Концепція "джерела забруднення" атмосфери
2.1. Основні джерела забруднення атмосферного повітря на промислових підприємствах 2.1.1. Концепція "джерела забруднення" атмосфери "Джерело забруднення"...
-
2.1. Основні джерела забруднення атмосферного повітря на промислових підприємствах 2.1.1. Концепція "джерела забруднення" атмосфери "Джерело забруднення"...
-
Промислова екологія - Апостолюк C. O. - Фарбувальні цехи
У машинобудуванні зараз широко застосовують склопластики, що містять скловолокнистий наповнювач і зв'язуючі смоли (фенолформальдегідні, епоксидні,...
-
Промислова екологія - Апостолюк C. O. - Зварювальні цехи
У машинобудуванні зараз широко застосовують склопластики, що містять скловолокнистий наповнювач і зв'язуючі смоли (фенолформальдегідні, епоксидні,...
-
Промислова екологія - Апостолюк C. O. - Барботажно-пінні пиловловлювачі
Значного поширення на промислових підприємствах набули пиловловлювачі мокрого очищення повітря від пилу, особливо дрібнодисперсного d > 0,3-1,0 мкм у...
-
Промислова екологія - Апостолюк C. O. - Мокрий форсунковий скрубер
Значного поширення на промислових підприємствах набули пиловловлювачі мокрого очищення повітря від пилу, особливо дрібнодисперсного d > 0,3-1,0 мкм у...
-
Промислова екологія - Апостолюк C. O. - Мокрі відцентрові пиловловлювачі
Значного поширення на промислових підприємствах набули пиловловлювачі мокрого очищення повітря від пилу, особливо дрібнодисперсного d > 0,3-1,0 мкм у...
-
Промислова екологія - Апостолюк C. O. - Скрубери Вентурі
Значного поширення на промислових підприємствах набули пиловловлювачі мокрого очищення повітря від пилу, особливо дрібнодисперсного d > 0,3-1,0 мкм у...
-
Значного поширення на промислових підприємствах набули пиловловлювачі мокрого очищення повітря від пилу, особливо дрібнодисперсного d > 0,3-1,0 мкм у...
-
Внаслідок інтенсивного використання деревообробними підприємствами водних ресурсів відбувається забруднення водоймищ, що у результаті призводить до...
-
Промислова екологія - Апостолюк C. O. - Цехи з виробництва неметалевих матеріалів
У машинобудуванні зараз широко застосовують склопластики, що містять скловолокнистий наповнювач і зв'язуючі смоли (фенолформальдегідні, епоксидні,...
-
Промислова екологія - Апостолюк C. O. - 1.5. Вплив людини на природне середовище
Одним із факторів, що негативно впливає на природне середовище, є урбанізація (термін "урбанізація" в перекладі з латинської мови означає...
-
Промислова екологія - Апостолюк C. O. - Перетворення оксиду в діоксид вуглецю
Оксид вуглецю - високотоксичний газ, продукт неповного згоряння палива у двигунах внутрішнього згоряння, в доменних печах і вагранках металургійних та...
-
Промислова екологія - Апостолюк C. O. - 4.8. Очищення газів від оксиду вуглецю
Оксид вуглецю - високотоксичний газ, продукт неповного згоряння палива у двигунах внутрішнього згоряння, в доменних печах і вагранках металургійних та...
Промислова екологія - Апостолюк C. O. - 5.5. Хімічне очищення стічних вод